LC-MS在蛋白质组学中的普及很大程度上是技术创新追赶大创意的故事,并且与二维凝胶电泳和微阵列研究等传统技术所限制的情况相比,LC-MS的应用已大大拓宽了领域。原则上,针对蛋白质组学优化的质谱仪由四个部分组成:
离子源;
质量分析仪,用于测量离子化分析物的质荷比(m / z);
一种以给定的m / z比定量离子的检测器;和
基于MS光谱的识别感兴趣离子并获得结构信息的分析算法
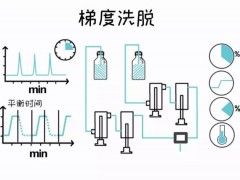
电离和质量分析器系统的变化适用于不同的蛋白质组学策略。最常见的两个电离平台是电喷雾电离(ESI)和基质辅助激光解吸/电离(MALDI)。前者的发明为田中浩一(Koichi Tanaka)获得了2002年诺贝尔化学奖,这是由于他对革命性的“自下而上”和高通量蛋白质组学(通常与离子阱或Orbitrap质量分析仪结合使用)做出的贡献。质谱分析仪的内在灵敏度,分辨率,准确性和获得片段化肽段独特光谱的能力各不相同。分析仪平台包括四极杆,傅立叶变换离子回旋共振和飞行时间(TOF)。 MALDI-TOF分析通常用于较小规模的蛋白质组学研究中,以表征蛋白质相互作用网络。
对于广泛的,以发现为导向的蛋白质组学分析,研究人员倾向于“自下而上”的方法。在这种策略中,生物样品(例如细胞提取物或动物组织)中的蛋白质被消化成较小的肽,进行分馏,然后进行LC-MS采集m / z和强度测量结果,从而产生明显的质量指纹。在串联质谱(MS / MS)系统中,其他肽段测序可以增强初始有效性和可信度。根据肽谱,研究人员可以推断出蛋白质的身份,根据峰强度可以量化起始样品中的相对丰度。利用可以链接到MS光谱数据库的分析算法,可以将该过程自动化到一定程度。由于当前仪器的灵敏度可以低至attomolar(10-18 mol)的浓度,因此可以广泛而可重复地覆盖相当全面的快照功能蛋白质组。
近年来,使用LC-MS的蛋白质组学作为一种简化药物开发流程的手段,对制药业以及为识别基于小分子的治疗药物的新的潜在先导化合物的学术研究人员,已变得极为有吸引力。制药管道的总体流程如下:
目标ID和验证
领先一代
潜在客户优化
从动物研究到一期临床试验的临床前开发
从第一阶段到第二阶段和第三阶段的临床开发和批准
学术方法更为随意,通常涉及高通量化学筛选以首先鉴定具有有趣生物学功能的新分子,然后进行各种经验研究以尝试确定其蛋白质靶标。预计大多数研究用新药会在药品销售渠道的某个地方失败,但如果公司在以后的试验阶段失败,则可能会损失数千万美元的资金。通过一种称为CETSA-MS的新兴蛋白质组学技术,制药公司可以在开发的早期就做出不做决定,以免浪费时间和金钱,而且学术研究人员可以放心地更快地确定目标。细胞热位移分析(CETSA)依赖于与与其同源靶蛋白结合的分子或配体相关的焓的增加,从而赋予了抵抗高温的构象稳定性。与LC-MS结合使用,这是一种“自下而上”的蛋白质组学技术,其中通过质量标签标记分离的蛋白质,从而可以并行鉴定和定量数千种蛋白质。蛋白质解链温度的升高对应于潜在的靶向事件,并且迭代分析可以依次缩小潜在靶标的范围以定义靶标参与。同样重要的是,该分析可以识别出意料之外的蛋白质的脱靶结合事件。
通过这种方式,研究人员例如已经阐明了一种机制,该机制对与几种类型的癌症有关的一种名为间变性淋巴瘤激酶(ALK)的蛋白质的小分子抑制剂具有化学抗性。首先,一项CETSA研究证实了抑制剂克唑替尼靶向ALK蛋白。其次,CETSA-MS在表达高水平称为β-catenin的蛋白质的细胞亚群中发现了竞争作用,这种蛋白质干扰了Crizotinib-ALK的结合,使其作用降低。由于蛋白质组学研究的这种简单力量,制药公司将研究和开发资源用于建立和增强其CETSA-MS功能,而学术生物医学研究机构也在其蛋白质组学核心内开发专用的CETSA-MS设施。此外,诸如Pelago Bioscience之类的基于合同的公司正在提供基于CETSA的服务,用于发现目标ID和/或确认,脱离目标发现,路径反卷积和作用方式研究。这些技术和服务处于蛋白质组学革命的前沿。